Ein wichtiger Schritt in diese Richtung gelang nun - koordiniert durch den Genetiker Ronald Roepman aus Nijemegen - einer internationalen Forschergruppe unter Beteiligung eines Teams des GSF-Forschungszentrums für Umwelt und Gesundheit: Sie identifizierten ein weiteres Gen für die erbliche Netzhauterkrankung Lebersche kongenitale Amaurose (LCA) und fanden erste Anhaltspunkte für dessen Funktion. Dies eröffnet neue Chancen für eine Gentherapie, die gerade bei LCA als viel versprechend betrachtet wird, da die Krankheit durch eine einzige Mutation ausgelöst wird.
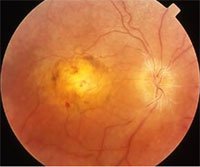
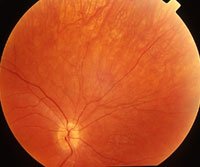
LCA führt sehr früh - oft schon kurz nach der Geburt bzw. noch im ersten Lebensjahr - zur Erblindung. Verursacht werden kann die Krankheit durch eine einzige Mutation in verschiedenen Genen - mit dem neu entdeckten LCA5-Gen wurden bisher zehn krankheitsauslösende Gene identifiziert, die insgesamt für etwa 60 Prozent aller LCA-Erkrankungen verantwortlich sind. "Die verschiedenen Defekte führen zwar letztendlich alle zum selben Krankheitsbild, um die Krankheit beim einzelnen Patienten gezielt behandeln zu können, ist es aber wichtig zu wissen, welche Genveränderung im Einzelfall vorliegt und was sie bewirkt", betont Dr. Marius Ueffing (GSF-Institut für Humangenetik), der das Projekt an der GSF leitet.
Das LCA5-Gen codiert für Lebercilin, ein bisher unbekanntes Protein. Mittels proteomischer Methoden konnte Ueffings Team zeigen, dass Lebercilin spezifisch mit anderen Proteinen interagiert, die eine Rolle beim Proteintransport in Zellen spielen. Daraus schließen die Wissenschaftler, dass Lebercilin für den Proteintransport innerhalb der Sehzelle eine wichtige Rolle spielt: Lebercilin bindet - das zeigen elektronenmikroskopische Aufnahmen - innerhalb der als Photorezeptor bezeichneten Sehzelle am stärksten am sogenannten Cilium, der Verbindungsstelle zwischen den inneren und äußeren Segmenten des Photorezeptors. Über dieses "molekulare Förderband" muss auch das Sehpurpur ins äußere Segment der Sehzelle transportiert werden. Dort findet die Rezeption des Lichtes statt. Ist die Lebercilin-Synthese gestört, kann, so die Arbeitshypothese der Forscher, verbrauchtes Sehpurpur im Außensegment nicht mehr ersetzt werden und das Sehvermögen geht verloren.
Ganz ähnliche Transportprozesse spielen auch in anderen Körperbereichen eine Rolle, z.B. in der Niere. Lebercilin ist Teil eines komplexen Netzwerks von Proteinen, die ciliäre Transportprozesse steuern oder daran direkt beteiligt sind. Störungen in der Zusammenarbeit solcher molekularer Netzwerke auf der Ebene von Proteininteraktionen bilden oft die molekulare Grundlage von Erkrankungen. Im Falle ciliärer Erkrankungen (Ciliopathien) führen Funktionseinschränkungen des Ciliums zu Taubheit, Blindheit oder auch schweren Syndromerkrankungen. LCA ist daher ein gutes Modell, durch das langfristig auch mehr Erkenntnisse über andere, schwer behandelbare Krankheiten gewonnen werden können.
LCA selbst ist bisher unheilbar. Patienten und Mediziner setzen aber große Hoffnungen in die Gentherapie: Da jeder Form von LCA die Mutation eines einzelnen Gens zugrunde liegt, könnte den Betroffenen durch den Austausch dieses Gens geholfen werden. Eine solche Gentherapie für LCA ist in Hunden, bei denen LCA natürlich vorkommt, bereits erfolgreich angewendet worden: Die behandelten Hunde können mit dieser Therapie wieder dauerhaft sehen. Eine klinische Studie an zwölf menschlichen Patienten läuft zur Zeit an einem großen Krankenhaus in London mit ermutigenden Ergebnissen. Sollten diese sich dauerhaft bestätigen, schätzt Ueffing, dass in fünf bis zehn Jahren auch eine Gentherapie für Defekte im LCA5-Gen zur Verfügung steht. " Die Betroffenen drängen auf ein rascheres Vorgehen" betont Ueffing, " jedoch haben Forscher und Ärzte bei der Entwicklung und dem Einsatz der Gentherapie eine hohe Verantwortung. Hier müssen sehr hohe Standards für die Sicherheit gesetzt werden".