Membranproteine spielen viele essenzielle Rollen beim Stoff- und Informationsaustausch zwischen und innerhalb von Zellen. Fehlfunktionen dieser wichtigen Klasse von Biomolekülen führen oft zu schweren Krankheiten, weshalb Membranproteine sowohl in der Grundlagen- als auch in der Wirkstoffforschung intensiv erforscht werden. Eine große Hürde für in-vitro-Untersuchungen - also Studien im Reagenzglas unter genau kontrollierten Bedingungen - sind dabei die hohen Anforderungen, die Membranproteine an ihre Umgebung stellen. Da diese Moleküle sich in Wasser und ähnlichen polaren Flüssigkeiten nicht lösen lassen, sind Forscherinnen und Forscher auf sogenannte „membranmimetische“ Systeme angewiesen, die die natürliche Lipidumgebung mit einer wasserabweisenden Schicht zwischen zwei wasserzugänglichen Grenzflächen möglichst gut nachbilden.
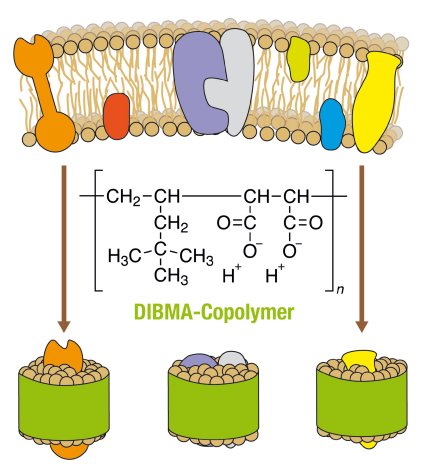
Traditionellerweise kommen als membranmimetische Systeme entweder einige Nanometer kleine Mizellen oder größere Liposomen zum Einsatz. Mizellen sind im Wesentlichen kleine Fetttröpfchen, die sich aufgrund ihrer geringen Größe ideal für viele in-vitro-Methoden eignen, aber die komplexen Eigenschaften einer biologischen Membran leider nur schlecht wiedergeben. Liposomen können das wesentlich besser, sind allerdings mit zahlreichen Labortechniken inkompatibel, da ihre Größe mit optisch-spektroskopischen Methoden interferiert, bei denen die Wechselwirkung von Licht mit Materie gemessen wird. Seit einigen Jahren setzen deshalb immer mehr Forscherinnen und Forscher auf Nanodiscs, also auf scheibenförmige membranmimetische Systeme im Nanometerbereich, die die vorteilhaften Eigenschaften von Mizellen und Liposomen in sich vereinen, indem sie eine Membranumgebung im kleinen Maßstab ausbilden (siehe Abbildung).
Wissenschaftlerinnen und Wissenschaftler der Technischen Universität Kaiserslautern haben neue Nanodiscs entwickelt, die von einem Polymer umschlossen und stabilisiert werden. Das Besondere daran ist, dass dieses Polymer im Gegensatz zu bisher verfügbaren Varianten keine aromatischen Reste enthält, also keine chemischen Bestandteile, die Licht im Ultraviolett-Bereich besonders stark absorbieren. Außerdem ist das Polymer in der Lage, Proteine direkt aus zellulären Membranen zu extrahieren und dabei sowohl die Grundstruktur der Membran als auch die lokale Lipidzusammensetzung zu erhalten. Wie das Wissenschaftlerteam nun in der renommierten Fachzeitschrift Angewandte Chemie berichtet, ist es dadurch zum ersten Mal möglich, Membranproteine unmittelbar nach ihrer Extraktion in einer nanometerskaligen Lipidumgebung mithilfe von Ultraviolett-Spektroskopie zu untersuchen.
Originalveröffentlichung:
Deutsch: A. Oluwole, B. Danielczak, A. Meister, J. Babalola, C. Vargas, S. Keller. Angew. Chem. 2016, DOI: 10.1002/ange.201610778R1
Englisch: A. Oluwole, B. Danielczak, A. Meister, J. Babalola, C. Vargas, S. Keller. Angew. Chem. Int. Ed. 2016, DOI: 10.1002/anie.201610778R1